Par Christophe BONNIN, Nice, France et Patrick BOUILLY, Cergy-Pontoise, France
Résumé
Les inhibiteurs de la phosphodiestérase 5 (IPDE5), représentés par le sildénafil, le vardenafil et le tadalafil, ont prouvé depuis la fin des années 90 leur efficacité et leur bonne tolérance dans le traitement de la dysfonction érectile (DE). Secondairement, la recherche s’est portée sur l’activité de ces molécules dans la dysfonction endothéliale, qui fait le lien étiologique entre la DE et les maladies cardiovasculaires, sur la fonction cardiaque ainsi que sur les artères coronaires et périphériques. Les mécanismes mis en évidence expliquant les effets bénéfiques des IPDE5 sont la vasodilatation artérielle pulmonaire et systémique, l’augmentation de la contractilité myocardique, l’amélioration de la fonction endothéliale, la réduction de l’apoptose, de la fibrose et de l’hypertrophie ventriculaire. Même si les indications reconnues des IPDE5 sont encore très limitées en dehors de la DE, leurs mécanismes d’action peuvent suggérer pour l’avenir de multiples perspectives thérapeutiques, notamment dans le phénomène de Raynaud, l’insuffisance cardiaque, l’hypertrophie ventriculaire, l’hypertension artérielle, la prévention cardio-vasculaire précoce ou encore les malformations lymphatiques.
Mots clés : inhibiteurs de la phosphodiestérase 5, dysfonction endothéliale, Raynaud, hypertension artérielle pulmonaire.
English title : Indications of phosphodiesterase type v inhibitors beyond erectile dysfunction: molecules of the future?
Summary
Efficacy and safety of the phosphodiesterase type V (PDE5) inhibitors (sildenafil, vardenafil, tadalafil) has been demonstrated since the 90s in erectile dysfunction (ED) treatment. Research then focused on these molecules’ activity on endothelial dysfunction, which ties ED and cardiovascular diseases, as well as on cardiac function and coronary and peripheral arteries. Highlighted mechanisms of the PDE5-inhibitors’ beneficial effects are pulmonary and systemic arteries vasodilation, increased myocardial contractility, and reduction in apoptosis, fibrosis, and ventricular hypertrophy. Although the presently recognized indications of PDE5-inhibitors are still restricted, except erectile dysfunction, the mechanisms of action of these drugs open many therapeutic avenues for the future, including more particularly Raynaud’s phenomenon, chronic heart failure, ventricular hypertrophy, high blood pressure, early cardiovascular prevention and lymphatic malformations.
Keywords : Phosphodiesterase type V Inhibitors, endothelial dysfunction, Raynaud’s disease, pulmonary arterial hypertension.
La phosphodiestérase 5 (PDE5) est une isoenzyme ubiquitaire, présente dans le tissu érectile mais également dans les parois artérielles et veineuses, les muscles squelettiques, viscéraux et trachéo-bronchiques, ainsi que dans les plaquettes.
La PDE5 fait partie des phosphodiestérases (PDE), protéines qui régulent le taux intracellulaire des nucléotides cycliques, regroupées en 11 familles et comprenant 60 isoformes.
Les PDE se différencient, entre autres, par leur sensibilité à leur inhibiteur et par leur spécificité à leur substrat (GMPc et/ou AMPc) (1) (Tableau).
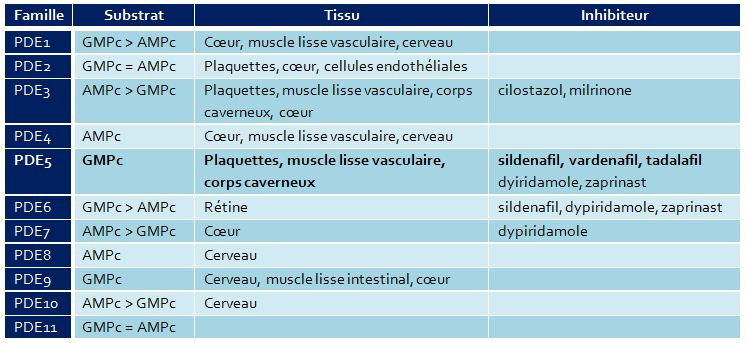
Tableau: Phosphodiestérases : substrats, effecteurs tissulaires, inhibiteurs (1)
L’activité principale de la PDE5 est d’hydrolyser le GMPc (guanosine monophosphate cyclique), second messager intracellulaire du monoxyde d’azote, en 5’GMP inactif. Les inhibiteurs de la phosphodiestérase 5 (IPDE5) empêchent cette dégradation et favorisent ainsi l’activité du NO. Le GMPc entraine l’activation d’une protéine kinase spécifique (Protéine Kinase G) qui elle-même induit une cascade biochimique aboutissant à la diminution du calcium intra-cellulaire et à la relaxation de la cellule musculaire lisse (CML) (Figure).
Depuis la fin des années 90, trois molécules (sildénafil, vardenafil, tadalafil) ont prouvé leur efficacité et leur bonne tolérance dans le traitement de la dysfonction érectile (DE). Par la suite, d’autres études ont montré l’action de ces molécules sur la dysfonction endothéliale, qui fait le lien étiologique entre la DE et les maladies cardiovasculaires, mais aussi sur la fonction cardiaque, les coronaires, les artères périphériques.
Pression artérielle
Les IPDE5 entrainent une baisse de la Pression Artérielle (PA) par leur effet relaxant sur les cellules musculaires lisses des artères résistives, sans modification significative de la fréquence et de l’index cardiaques. Chez les sujets sains, la baisse de PA est néanmoins très modeste et cliniquement insignifiante, de 1 à 10 mmHg sur la PA systolique (PAS) et sur la PA diastolique (PAD) en fonction des molécules et des doses. Elle peut être relativement plus marquée en position debout qu’en position allongée et chez les patients hypertendus traités ou non (2). La baisse modeste de la PA serait due à l’antagonisme des effets des IPDE5, également stimulants du système rénine angiotensine.
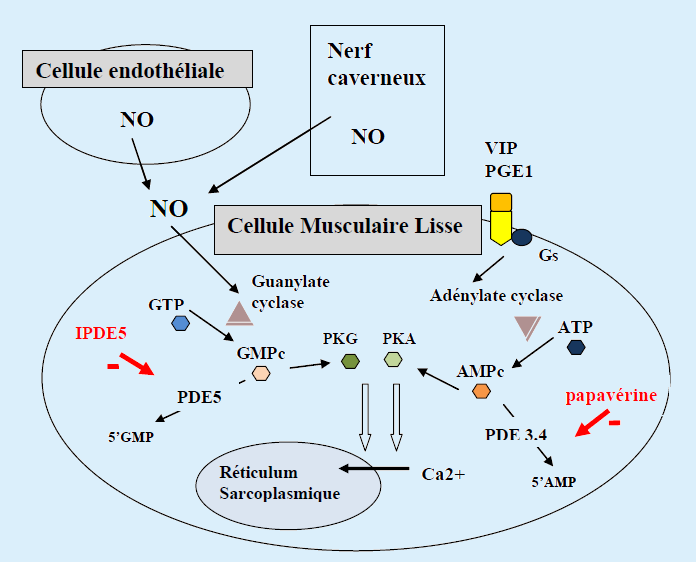
Figure: Cellule musculaire lisse caverneuse : effet du NO et des IPDE5.
L’association avec les α1-bloquants (en dehors de la tamsulosine) peut entrainer une hypotension orthostatique et nécessite des précautions d’emploi. Le vardenafil est contre-indiqué avec tous les α1-bloquants. Le tadalafil n’est pas contre-indiqué avec la tamsulosine. Le sildénafil à la dose de 25mg peut être associé à un α1-bloquant, et en cas de dose supérieure à 25mg, un délai de 4 heures doit être observé (3). L’association avec les donneurs de NO est contre-indiquée, en raison de baisses de pression artérielle beaucoup plus importantes, de l’ordre de 40 à 50 mmHg pour la PAS et 30 mmHg pour la PAD (4). Une étude récente a néanmoins montré que chez les patients ayant une HTA résistante à une trithérapie, la prise concomitante de 50mg de sildénafil et 10mg de dinitrate d’isosorbide n’entrainait qu’une chute de PAS/PAD relativement modérée, sans effet clinique indésirable (5), rendant potentiellement intéressants les IPDE5 chez ce type de patients. Chez un patient sous IPDE5 ayant une douleur angineuse, il est nécessaire d’attendre 24h avant d’administrer un donneur de NO avec le sildénafil et le vardenafil et 48h avec le tadalafil (grade B) (6).
Fonction cardiaque
Les PDE5 ne sont quasiment pas exprimées au niveau du myocarde et leur inhibition a peu d’effet sur la fonction cardiaque au repos (7). Sur un cœur soumis à une augmentation de la post-charge, il existe un phénomène de régulation intrinsèque médié par le GMPc luttant contre l’hypertrophie induite et le remodelage ventriculaire, insuffisant cependant dans les conditions physiologiques. Le sildénafil entraine chez la souris une prévention et une réduction du remodelage ventriculaire gauche créé expérimentalement (8). Les IPDE5 réduisent également le remodelage ventriculaire gauche post-infarctus chez le rat (9). Ils diminuent l’apoptose, la fibrose et l’hypertrophie ventriculaire (10). Chez les patients en insuffisance cardiaque, l’expression des IPDE5 est augmentée au niveau du ventricule gauche (11), et cette augmentation est corrélée aux marqueurs du stress oxydatif myocardique (9).
Les PDE5 ne sont pas exprimées au niveau du ventricule droit (VD) normal, mais leur expression est également nettement augmentée en cas d’hypertrophie ventriculaire droite. Chez l’homme, le sildénafil augmente la contractilité du VD hypertrophié, dans lequel l’activité de la protéine kinase G (PKG), spécifique du GMPc, est inhibée. Cet effet inotrope serait similaire à celui produit par l’isoprotérénol (12).
Dans les modèles animaux, les IPDE5 ont également montré un effet cardioprotecteur par réduction de la zone de l’infarctus quand ils sont administrés soit avant une occlusion coronaire soit durant la reperfusion coronaire (10).
Les trois IPDE5 entrainent une augmentation mineure du segment QT, inférieure à 10 ms, sans retentissement clinique. Le vardenafil entraine l’augmentation la plus importante (9ms avec 80 mg), raison pour laquelle il fut contre-indiqué chez les patients avec QT long congénital ou prenant des anti-arythmiques de classe Ia et III (13).
Artères coronaires
Les PDE5 étant exprimées au niveau des artères coronaires, il a été supposé que les IPDE5 pouvaient augmenter le flux sanguin coronaire. Chez le chien, le sildénafil entraine une augmentation très modeste du flux sanguin coronaire global dans le cœur normal. En revanche, cette augmentation est significative au niveau des zones myocardiques soumises à une ischémie d’effort en relation avec une sténose coronaire, et liée à la dilatation des artérioles coronaires résistives (14).
Chez les patients ayant une coronaropathie stable et soumis à une perfusion de dobutamine (augmentation du travail cardiaque), le tadalafil améliore le flux sanguin coronaire dans les zones myocardiques saines (en tomographie à émission de positrons), avec également une tendance favorable pour les zones myocardiques anormales (15). Sous perfusion d’adénosine, entrainant une hyperhémie, le sildénafil améliore la réserve coronaire dans les zones myocardiques anormales (dormantes ou infarcies) (16). La baisse de la rigidité pariétale des artères de conductance induite par le sildénafil, vérifiée par la diminution de la vitesse de l’onde de pouls (VOP) et l’augmentation de l’AIx (index d’augmentation), pourrait favoriser le flux sanguin coronaire (17).
Fonction endothéliale
La dysfonction endothéliale est considérée comme l’équivalent d’une altération fonctionnelle précoce qui précède le changement structurel de la paroi vasculaire. Elle résulte en une réduction de la biodisponibilité du NO par diminution de sa production et/ou surtout augmentation de sa dégradation, liée notamment au stress oxydatif. Elle fait surtout référence à l’altération des réponses vasodilatatrices endothélium-dépendantes. L’impact des IPDE5 sur la dysfonction endothéliale a été étudié 1/ sur le plan fonctionnel (mesure de la dilatation médiée par le flux ou FMD, de la rigidité pariétale, de la vitesse de l’onde de pouls) 2/ sur la modification des bio-marqueurs circulants moléculaires de l’inflammation (ICAM-1, VCAM-1, P-sélectine) et du tonus vasomoteur (NO, endothéline-1 ET-1) 3/ sur la modification des bio-marqueurs cellulaires (Progéniteurs Endothéliaux Circulants).
Il existe plusieurs études suggérant qu’une prise unique de sildénafil améliore jusqu’à la 24ème heure la relaxation endothélium-dépendante de l’artère (FMD), reflet de la dysfonction endothéliale systémique, chez les patients avec ou sans DE (18, 19), avec coronaropathie (20) ou en insuffisance cardiaque (21). L’amélioration de la dysfonction endothéliale est enregistrable jusqu’à une semaine après l’arrêt du sildénafil (18, 22). Le tadalafil en prise quotidienne améliore également la fonction endothéliale (23).
Les progéniteurs endothéliaux circulants (PEC) sont des cellules recrutées à partir de la moelle osseuse, capables de se différencier en cellules matures et de restaurer l’intégrité endothéliale (24). Des travaux ont rapporté une réduction du nombre et/ou de la fonctionnalité des PEC chez les patients atteints de coronaropathie, d’insuffisance cardiaque congestive, de maladies cérébrovasculaires ou de resténose de stent. Des déficits en PEC sont également documentés chez les patients présentant des facteurs de risque cardiovasculaire (diabète, hypertension, insuffisance rénale chronique, tabagisme). Le vardenafil en prise unique et le tadalafil en traitement prolongé ont été associés à une augmentation des PEC, le premier chez des patients en bonne santé (25) ou avec DE (26), le second chez des patients ayant une DE (27), suggérant un rôle des IPDE5 dans la production et/ou la mobilisation des PEC.
Inflammation sub-clinique
Une association entre la présence d’une dysfonction érectile et certains marqueurs d’inflammation infra-clinique (CRPus, interleukine-6, TNF-α), chez des patients avec ou sans coronaropathie, a été montrée dans plusieurs études (28, 29). L’administration régulière de tadalafil entrainerait une diminution de certains marqueurs (ET-1, VCAM-1, CRPus) chez les patients ayant une DE (23). La prise quotidienne de sildénafil entrainerait chez les patients diabétiques avec DE une baisse de ET-1, VCAM-1, ICAM-1, interleukine-6 et de la CRPus (22).
Stress oxydatif
L’augmentation des espèces réactives de l’oxygène (ERO) a été associée avec une altération de la fonction érectile, en relation avec une baisse de la concentration de NO (30). Dans des modèles animaux, le sildénafil inhibe in vitro la formation d’anion superoxyde (O2-) (31) et son administration chronique entraine une diminution du stress oxydatif comme en témoigne la baisse des taux urinaires d’isoprostane-8 (32).
Rigidité pariétale
L’augmentation de la rigidité artérielle, qui entraine une augmentation de la pression pulsée, témoigne également d’une altération vasculaire précoce et est considérée un marqueur pré-clinique indépendant de la maladie athéroscléreuse. Elle est évaluée par la vitesse de l’onde de pouls (VOP) carotido-fémorale, reflet de la VOP aortique, dont l’augmentation est étroitement liée aux facteurs de risque cardiovasculaires, en particulier l’HTA et le diabète (33). La quantification des ondes de réflexion au travers de la mesure de l’index d’augmentation (AIx) permet également une estimation de la rigidité artérielle. L’AIx est le rapport entre l’augmentation de la Pression Artérielle (PA) due à l’onde de réflexion et la Pression Pulsée (PP). Il a été montré que le sildénafil en prise unique entrainait une diminution de la VOP et de l’AIx chez les patients coronariens (17) ou en insuffisance ventriculaire gauche (34). Le vardénafil en prise quotidienne et à la demande améliore la rigidité artérielle mise en évidence par la réduction de l’AIx mesuré en tonométrie digitale. Cette amélioration a été reliée à une diminution de la concentration d’adrénomédulline, peptide qui a une action vasodilatatrice endothélium-dépendante (35) ou encore aux propriétés anti-inflammatoires des IPDE5 (36).
Plaquettes
Dans un modèle ex vivo, le sildénafil diminue l’agrégation plaquettaire induite par la thrombine (37). Il a été montré que le sildénafil augmentait le seuil d’activation des récepteurs GPIIb/IIIa sans modification de la dégranulation plaquettaire (20), inhibait l’activation de ces récepteurs induite par l’ADP (20) ainsi que l’agrégation plaquettaire induite par le collagène (38). Le tadalafil diminue également l’expression de la P-sélectine au niveau plaquettaire chez les patients avec DE et facteurs de risque cardiovasculaire (39).
Propriétés antifibrotiques
Le sildénafil entraine un effet antifibrotique sur les corps caverneux de rats âgés en améliorant le rapport CML/collagène, l’élévation des taux de GMPc inhibant le dépôt de collagène et/ou l’apoptose des CML, sans modification du rapport collagène III/I (40). Ces effets antifibrotiques du sildénafil administré pendant 45 jours corrigent la dysfonction veino-occlusive induite par la fibrose. Pour ces raisons, il a été envisagé que le sildénafil soit utilisé dans le traitement de pathologies fibrosantes.
APPLICATIONS THERAPEUTIQUES
Hypertension Artérielle Pulmonaire (HTAP)
Le traitement de l’HTAP est la seule indication reconnue des IPDE5 en dehors de celle de la dysfonction érectile. Les IPDE5 ont montré leur efficacité sur la baisse de la pression artérielle pulmonaire (PAP) et des résistances vasculaires pulmonaires (RVP) dans de nombreuses études. Les études SUPER-1 (sildénafil) (41) et PHIRST (tadalafil) (42) ont montré que ces molécules amélioraient non seulement les paramètres hémodynamiques (Index Cardiaque, PAP, RVP) mais également les capacités à l’effort des patients (test de marche pendant 6 minutes et classe fonctionnelle NYHA/WHO). Le sildénafil réduit également la masse ventriculaire droite évaluée en imagerie par résonance magnétique (12,43). Il augmente la contractilité du ventricule droit hypertrophié (12). De par leurs effets à la fois sur la vascularisation pulmonaire et sur le ventricule droit, les IPDE5 semblent être la thérapeutique idéale dans l’HTAP (44). Une étude récente a par ailleurs montré avec le vardénafil une diminution significative des évènements cliniques en termes de décès et d’hospitalisations (45).
A la suite des études SUPER-1 et PHIRST, le sildénafil (REVATIO® 20mg x 3/jour) en 2005 puis le tadalafil (ADCIRCA® 20mg x 2/jour) en 2009 ont été approuvés par l’EMEA (European Medicines Evaluation Agency) et la FDA (Food and Drug Administration) pour le traitement de l’HTAP (pré-capillaire, groupe clinique 1) idiopathique ou secondaire à une connectivite, chez les patients en classe fonctionnelle II et III. L’ESC recommande les IPDE5 comme traitement de 1ère intention avec un grade IA pour le sildénafil et un grade IB pour le tadalafil (46). L’AHA recommande les IPDE5 en 1ère intention chez les patients ayant un test de vasoréactivité négatif et un bon pronostic (47).
Œdème pulmonaire et HTAP de haute altitude
Au dessus de 2500m d’altitude, les poumons répondent à l’hypoxie en réduisant le NO biodisponible, entrainant une vasoconstriction et une augmentation de la PAP, pouvant entrainer un œdème pulmonaire de haute altitude (OPHA) chez les alpinistes ou une HTAP chez les sujets habitant au dessus de 3200m. Chez les alpinistes ayant un antécédent d’OPHA, le tadalafil réduit significativement le risque de récidive comparé au placebo. Le sildénafil améliore également les paramètres hémodynamiques pulmonaires et les capacités à l’effort des patients ayant une HTAP de haute altitude (10).
Cardiopathies
Les IPDE5 ont montré leur innocuité dans le traitement d’une dysfonction érectile chez les patients en insuffisance cardiaque classe II/III. Chez les patients en insuffisance cardiaque congestive, notamment chez ceux avec HTAP secondaire et insuffisance cardiaque droite, dans de petites études contrôlées, le sildénafil a entrainé une augmentation de la consommation d’O2, une diminution des résistances vasculaires systémiques et de la rigidité aortique, une amélioration des capacités à l’effort et de la qualité de vie (10).
Initialement testés dans le traitement de l’angor, les IPDE5 n’avaient montré qu’un bénéfice marginal. Chez les patients traités pour DE, les IPDE5 n’ont pas montré d’augmentation du risque d’infarctus non fatal, d’AVC ou de décès cardiovasculaires. Ils sont sans effet néfaste chez les patients qui ont une coronaropathie stable et qui ne prennent pas de donneurs de NO, mais ils sont contre-indiqués en cas d’IDM récent (<15jours), d’angor instable et de trouble du rythme ventriculaire (6,48). Ils pourraient avoir un effet favorable chez les patients présentant un angor spastique, une maladie coronaire microvasculaire ou devant bénéficier d’un pontage coronaire (49, 50).
AOMI, ischémie critique
Il semble que le sildénafil puisse stimuler l’angiogénèse induite par l’ischémie chronique de membre chez la souris, par le biais d’une augmentation du taux de GMPc et de l’activité de la protéine kinase G (51). Chez la souris dyslipidémique déficitaire en ApoE, le sildénafil stimule l’angiogénèse induite en augmentant les progéniteurs endothéliaux circulants (52). Le vardénafil exerce la même action, avec mobilisation de PEC (53).
Phénomène de Raynaud
Les IPDE5 ont été étudiés dans le phénomène de Raynaud en raison de leurs effets micro et macrovasculaires, jusqu’à présent sur de petites séries de patients (54). Ces molécules se sont révélées efficaces chez les patients présentant un phénomène de Raynaud secondaire avec symptômes sévères malgré la prise d’un traitement conventionnel, avec une diminution de la fréquence et de la sévérité des crises (amélioration du Raynaud Condition Score), voire une guérison des troubles trophiques. Une étude récente a ainsi montré que chez les patients présentant un phénomène de Raynaud secondaire (sclérodermie systémique, focale ou connective mixte) résistant aux inhibiteurs calciques +/ vasodilatateurs (ARA2/IEC), le tadalafil, en association avec le traitement conventionnel, améliorait les symptômes, prévenait l’apparition et guérissait les ulcères, avec une amélioration de la qualité de vie (55).
Malformations lymphatiques
Très récemment, a été rapporté la régression inattendue d’une malformation lymphatique microkystique thoraco-brachiale chez un nourrisson de 2 mois ½ traité 4 mois par sildenafil pour une HTAP idiopathique (56). Par la suite, deux autres enfants de 12 et 15 mois avec des malformations lymphatiques faciale et dorsale ont été traités avec succès, suscitant la réalisation d’une étude en double aveugle contre-placebo (en cours).
L’effet des IPDE5 serait lié à la relaxation de la musculature lymphatique et à la correction de la dysfonction endothéliale lymphatique.
CONCLUSIONS
Les mécanismes expliquant les effets bénéfiques des IPDE5 sont la vasodilatation artérielle pulmonaire et systémique, l’augmentation de la contractilité myocardique, l’amélioration de la fonction endothéliale, la réduction de l’apoptose, de la fibrose et de l’hypertrophie ventriculaire.
Même si les indications actuelles reconnues des IPDE5 sont très limitées, ces mécanismes d’action peuvent suggérer pour l’avenir de multiples perspectives thérapeutiques, notamment dans le phénomène de Raynaud, l’insuffisance cardiaque, l’hypertrophie ventriculaire, l’hypertension artérielle, la prévention cardio-vasculaire précoce ou encore les malformations lymphatiques.
Bibliographie
- Gresele P, Momi S, Falcinelli E. Anti-platelet therapy: phosphodiesterase inhibitors. Br J Clin Pharmacol 2011 ; 72 : 634–646
- Prisant LM. Phosphodiesterase-5 inhibitors and their hemodynamic effects. Curr Hypertens Rep 2006;8:345–51.
- Kloner RA. Cardiovascular effects of the 3 Phosphodiesterase-5 Inhibitors approved for the treatment of erectile dysfunction. Circulation 2004; 110:3149-3155.
- Webb DJ, Muirhead GJ, Wulff M, et al.: Sildenafil citrate potentiates the hypotensive effects of nitric oxide donor drugs in male patients with stable angina. J Am Coll Cardiol 2000, 36:25–31.
- Oliver JJ, Dear JW, Webb DJ. Inhibitor in Treatment-Resistant Hypertension Clinical Potential of Combined Organic Nitrate and Phosphodiesterase Type 5. Hypertension 2010;56:62-67.
- Levine GN, Steinke EE, Bakaeen FG et al. Sexual activity and cardiovascular disease : A Scientific Statement From the American Heart Association. Circulation published online January 19, 2012.
- Corbin, J. et al. Sildenafil citrate does not affect cardiac contractility in human or dog heart. Curr Med Res Opin 2003; 19, 747–752
- Takimoto E, Champion HC, Li M et al. Chronic inhibition of cyclic GMP phosphodiesterase 5A prevents and reverses cardiac hypertrophy. Nat Med 2005;11:214–22.
- Lu Z, Xu X, Hu X, et al. Oxidative stress regulates left ventricular PDE5 expression in the failing heart. Circulation 2010;121:1474–83.
- Schwartz BG, Levine LA, Comstock G et al. Cardiac uses of phosphodiesterase-5 inhibitors. J Am Coll Cardiol 2012, 59 :9-15.
- Pokreisz P, Vandenwijngaert S, Bito V et al. Ventricular phosphodiesterase-5 expression is increased in patients with advanced heart failure and contributes to adverse ventricular remodeling after myocardial infarction in mice. Circulation 2009;119:408–416.
- Nagendran J, Archer SL, Soliman D et al. Phosphodiesteras type 5 (PDE5) is highly expressed in the hypertrophied human right ventricle and acute inhibition of PDE5 improves contractility. Circulation 2007;116:238–48.
- Carson CC. Cardiac safety in clinical trials of phosphodiesterase 5 inhibitors. Am J Cardiol 2005; 96:37M–41M.
- Traverse JH, Chen YJ, Du R, Bache RJ. Cyclic nucleotide phosphodiesterase type 5 activity limits blood flow to hypoperfused myocardium during exercise. Circulation 2000; 102: 2997–3002.
- Weinsaft JW, Hickey K, Bokhari S et al. Effects of tadalafil on myocardial blood flow in patients with coronary artery disease. Coron Artery Dis 2006;17:493–9.
- Tawakol A, Aziz K, Migrino R et al. Effects of sildenafil on myocardial blood flow in humans with ischemic heart disease. Coron Artery Dis 2005;16:443–9.
- Vlachopoulos C, Hirata K, O’Rourke MF. Effect of sildenafil on arterial stiffness and wave reflection. Vasc Med 2003;8:243–8.
- Desouza C, Parulkar A, Lumpkin D et al. Acute and prolonged effects of sildenafil on brachial artery flow-mediated dilatation in type 2 diabetes. Diabetes Care 2002;25: 1336–9.
- Gori T, Sicuro S, Dragoni S et al. Sildenafil prevents endothelial dysfunction induced by ischemia and reperfusion via opening of adenosine triphosphate-sensitive potassium channels: A human in vivo study. Circulatio, 2005;111:742–6.
- Halcox JP, Nour KR, Zalos G et al. The effect of sildenafil on human vascular function, platelet activation, and myocardial ischemia. J Am Coll Cardiol, 2002;40:1232– 4.
- Katz SD, Balidemaj K, Homma S et al. Acute type 5 phosphodiesterase inhibition with sildenafil enhances low-mediated vasodilation in patients with chronic heart failure. J Am Coll Cardiol 2000;36:845–51.
- Aversa A, Vitale C, Volterrani M et al. Chronic administration of sildenafil improves markers of endothelial function in men with type 2 diabetes. Diabet Med 2008; 25:37–44.
- Aversa A, Greco E, Bruzziches R et al. Relationship between chronic tadalafil administration and improvement of endothelial function in men with erectile dysfunction: A pilot study. Int J Impot Res 2007;19:200–7.
- Sabatier F, Lacroix R, Camoin-Jau L et al. Cellules endothéliales circulantes, microparticules et progéniteurs : vers la définition de la « vasculocompétence » Rev Med Int, 2011 ; 32 : 54–63
- Foresta C, Caretta N, Lana A et al. Circulating endothelial progenitor cells in subjects with erectile dysfunction. Int J Impot Res 2005; 17: 288–290.
- Foresta C, Caretta N, Lana A et al. Relationship between vascular damage degrees and endothelial progenitor cells in patients with erectile dysfunction: Effect of vardenafil administration and PDE5 expression in the bone marrow. Eur Urol 2007;51:1411–7.
- Foresta C, Ferlin A, De Toni L, Lana A, Vinanzi C, Galan A, Caretta N. Circulating endothelial progenitor cells and endothelial function after chronic tadalafil treatment in subjects with erectile dysfunction. Int J Impot Res 2006;18:484–8.
- Vlachopoulos C, Aznaouridis K, Ioakeimidis N et al. Unfavourable endothelial and inflammatory state in erectile dysfunction patients with or without coronary artery disease. Eur Heart J 2006;27:2640–8.
- Vlachopoulos C, Rokkas K, Ioakeimidis N, Stefanadis C. Inflammation, metabolic syndrome, erectile dysfunction, and coronary artery disease: Common links. Eur Urol 2007;52:1590–600.
- Jeremy JY, Koupparis A, Muzaffar S et al. Is the therapeutic action of sildenafil mediated partly through the inhibition of superoxide formation? BJU Int 2005; 95:930–1.
- Muzaffar S, Shukla N, Srivastava A et al. Sildenafil citrate and sildenafil nitrate (NCX 911) are potent inhibitors of superoxide formation and gp91phox expression in porcine pulmonary artery endothelial cells. Br J Pharmacol 2005;146:109–17.
- Behr-Roussel D, Oudot A, Caisey S, Coz OL, Gorny D, Bernabé J, Wayman C, Alexandre L, Giuliano FA. Daily treatment with sildenafil reverses endothelial dysfunction and oxidative stress in an animal model of insulin resistance. Eur Urol 2008;53:1272–81.
- Laurent S, Cockcroft J, Van Bortel L et al. European Network for Non-invasive Investigation of Large Arteries. Expert consensus document on arterial stiffness: methodological issues and clinical applications. Eur Heart J. 2006, 27: 2588-605.
- Hirata K, Adji A, Vlachopoulos C, O’Rourke MF. Effect of sildenafil on cardiac performance in patients with heart failure. Am J Cardiol 2005; 96:1436–40.
- Aversa A,Letizia C,Francomano D et al. A spontaneous, double-blind, double-dummy cross-over study on the effects of daily vardenafil on arterial stiffness in patients with vasculogenic erectile dysfunction. Int J Cardiol. 2011, advanced publication on line.
- Vlachopoulos C, Dima I, Aznaouridis K et al. Acute systemic inflammation increases arterial stiffness and decreases wave reflections in healthy individuals. Circulation 2005;112:2193–200.
- Lewis GD, Witzke C, Colon-Hernandez P et al. Sildenafil improves coronary artery patency in a canine model of platelet-mediated cyclic coronary occlusion after thrombolysis. J Am Coll Cardiol 2006;47:1471–7.
- Berkels R, Klotz T, Sticht G et al. Modulation of human platelet aggregation by the phosphodiesterase type 5 inhibitor sildenafil. J Cardiovasc Pharmacol 2001; 37: 413–21.
- De Bon E, Bonanni G, Saggiorato G et al. Effects of tadalafil on platelets and endothelium in patients with erectile dysfunction and cardiovascular risk factors: a pilot study. Angiology 2010; 61: 602–6.
- Ferrini MG, Kovanecz I, Sanchez S et al. Long-term continuous treatment with sildénafil ameliorates aging-related erectile dysfunction and the underlying corporal fibrosis in the rat. Biol Reprod 2007;76:915–23.
- Galié N, Ghofrani HA, Torbicki A et al. Sildenafil citrate therapy for pulmonary arterial hypertension. N Engl J Med 2005 ; 353:2148–2157.
- Galiè N, Brundage BH, Ghofrani HA at al.Tadalafil Therapy for Pulmonary Arterial Hypertension Circulation 2009;119:2894-2903
- Michelakis ED, Tymchak W, Noga M et al. Long-term treatment with oral sildenafil is safe and improves functional capacity and hemodynamics in patients with pulmonary arterial hypertension. Circulation 2003;108:2066–9.
- Archer SL, Michelakis ED. Phosphodiesterase type 5 inhibitors for pulmonary arterial hypertension. N Engl J Med 2009;361:1864 –71.
- Jing ZC, Yu ZX, Shen JY, et al. Vardenafil in Pulmonary Arterial Hypertension : A Randomized, Double-blind, Placebo-controlled Study for the Efficacy and Safety of Vardenafil in the Treatment of Pulmonary Arterial Hypertension (EVALUATION) Study Group. Am J Respir Crit Care 2011 ; 183 :1723–29.
- Guidelines for the diagnosis and treatment of pulmonary hypertension. The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J 2009 ; 30 :2493–2537
- ACCF/AHA 2009 Expert Consensus Document on Pulmonary Hypertension : A Report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association in Collaboration With the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association. J. Am. Coll. Cardiol 2009; 53:1573-1619
- Kostis JB, Jackson G, Rosen R et al. Sexual dysfunction and cardiac risk (the Second Princeton Consensus Conference). Am J Cardiol 2005;96: 313–21.
- Denardo SJ, Wen X, Handberg EM et al. Effect of phosphodiesterase type 5 inhibition on microvascular coronary dysfunction in women: a Women’s Ischemia Syndrome Evaluation (WISE) ancillary study. Clin Cardiol 2011, 34 :483–487.
- Vlachopoulos C, Ioakeimidis N, Rokkas K, Stefanadis C. Cardiovascular Effects of Phosphodiesterase Type 5 Inhibitors. J Sex Med 2009;6:658–674.
- Senthilkumar A, Smith RD, Khitha J et al. Sildenafil promotes ischemia-induced angiogenesis through a PKG dependent pathway. Arterioscler Thromb Vasc Biol 2007;27:1947–54.
- Dussault S, Maingrette F, Menard C, et al. Sildenafil Increases Endothelial Progenitor Cell Function and Improves Ischemia-Induced Neovascularization in Hypercholesterolemic Apolipoprotein E–Deficient Mice. Hypertension 2009;54:1043-1049.
- Sahara M, Sata M, Morita T et al. A Phosphodiesterase-5 Inhibitor Vardenafil Enhances Angiogenesis Through a Protein Kinase G–Dependent Hypoxia-Inducible Factor-1/Vascular Endothelial Growth Factor Pathway. Arterioscler Thromb Vasc Biol 2010;30:1315-1324.
- Levien TL. Advances in the treatment of Raynaud’s phenomenon. Vasc Health Risk Management 2010:6 167–177.
- Shenoy PD, Kumar S, Jha ,LK. Efficacy of tadalafil in secondary Raynaud’s phenomenon resistant to vasodilator therapy: a double-blind randomized cross-over trial. Rheumatol 2010;49:2420–2428.
- Swetman GL, Berk DR, Vasanawala SS, Feinstein JA, Lane AT, Bruckner AL. Sildenafil for severe lymphatic malformations. N Engl J Med 2012, 366:384-6.